作者:柏思荟
01 信达生物PI3Kδ抑制剂上市临近
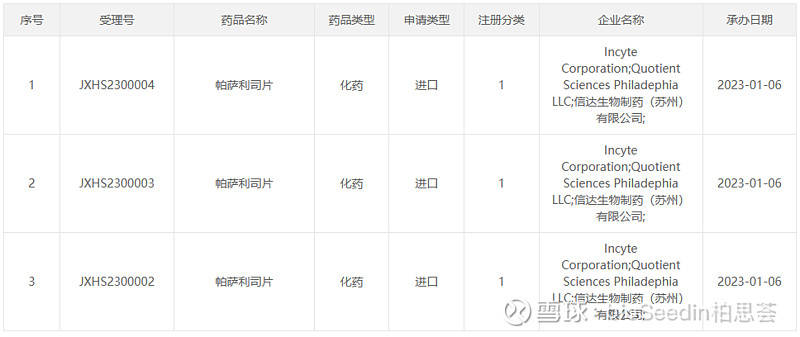
昨日(1月6日),CDE官网公示,信达生物与Incyte共同申报了1类新药——帕萨利司片(parsaclisib,研发代号:IBI376)的新药上市申请,并获得受理。
帕萨利司片是一款高选择性、新一代PI3Kδ口服抑制剂,拟用于治疗既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)的成人患者。该药曾在2022年10月被CDE纳入优先审评程序。
FL是患病率第二高的一类非霍奇金淋巴瘤(NHL),尽管大多数FL患者对一线治疗响应,但FL通常持续复发,而当前复发或难治性FL的治疗手段仍十分有限,存在未满足的临床需求。
此次NDA受理基于一项在中国开展的II期临床(NCT04298879)研究结果。帕萨利司单药在既往接受过至少两种系统性治疗的FL患者 (n=61) 中,客观缓解率(ORR)为86.9%,完全缓解率(CR)为31.1%,部分缓解(PR)率为55.7%。中位缓解持续时间(DOR)和中位无进展生存期(PFS)尚未达到。
安全性方面,有27例患者(44.3%)发生了≥3级的治疗期间不良事件(TEAE),最常见的≥3级TEAEs为中性粒细胞计数减少(n=10,16.4%)。
信达生物制药和美国Incyte在2018年12月达成战略合作和独家开发协议,信达生物以高达约3.9亿美元(含4000万美元首付款)的总金额引进了pemigatinib(FGFR1/2/3抑制剂)、itacitinib(JAK1抑制剂)及parsaclisib(PI3Kδ抑制剂)三款产品。
其中,达伯坦(佩米替尼片,pemigatinib)已于2022年4月在中国大陆获得批准,用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。
不过值得注意的是,2022年1月,Incyte公司曾发布公告,宣布撤回PI3Kδ抑制剂Parsaclisib用于治疗复发或难治性滤泡性淋巴瘤(FL)、边缘区淋巴瘤(MZL)和套细胞淋巴瘤(MCL)在美国的新药上市申请。
Incyte官网指出,撤回NDA是一项商业决定,与药品疗效和安全性均无关。该决定仅影响美国的三项血液瘤,不影响美国或其他国家正在进行的其他临床试验。
02 PI3K抑制剂研发格局
磷脂酰肌醇-3-激酶(PI3K,phosphatidylinositol 3-kinase)是一种胞内磷脂酰肌醇激酶,PI3K在癌症和免疫失调中广泛过度激活,促使了治疗性PI3K抑制剂的开发。
PI3K药物适应症目前以肿瘤为主,已获批上市的PI3K抑制剂大多数用于治疗血液肿瘤,只有一款已获批用于乳腺癌(诺华Alpelisib)。PI3Kδ是目前已上市或正在开发的恶性血液病中PI3K抑制剂最常用的治疗靶点。
