作者:飞速度CRO
今日,药监局连发三文来支撑医疗器械注册人制度的大力发展,《加强委托生产管理》、《推行医疗器械注册人制度》、《贯彻“放管服”改革精神》三文中都是为了注册人制度进行鼓励发展.首先,跟随飞速度要先了解医疗器械注册人制度是什么模式?
什么是医疗器械注册人制度?
官方的说法是“注册人制度,是基于注册人对医疗器械全生命周期质量负主体责任的制度,其核心要义是将原有的注册证持有人与生产许可证持有人需要为同一公司主体的模式解绑为可以是两个不同的公司主体分别持有。医疗器械注册人对研制、生产、经营、使用全过程的医疗器械安全性、有效性依法承担责任。在该制度下,符合条件的医疗器械注册人可以自行生产也可以委托给有资质和生产能力的企业生产,从而实现医疗器械产品注册和生产许可的“解绑”。”
说的通俗点就是医疗器械注册人自己想要做生产医疗器械,但是自己想要快速上市或者战略发展先不想建立厂房,委托有生产产品实力的生产厂进行代生产。这样不但可以降低注册人的生产成本,加速产品的上市进程。生产厂还可以接到注册人的生产单子,充分利于自己的闲置的生产力,最后就是可以节省不必要的生产用地和能源消耗,是非常利好中小医疗器械生产公司的前期发展。
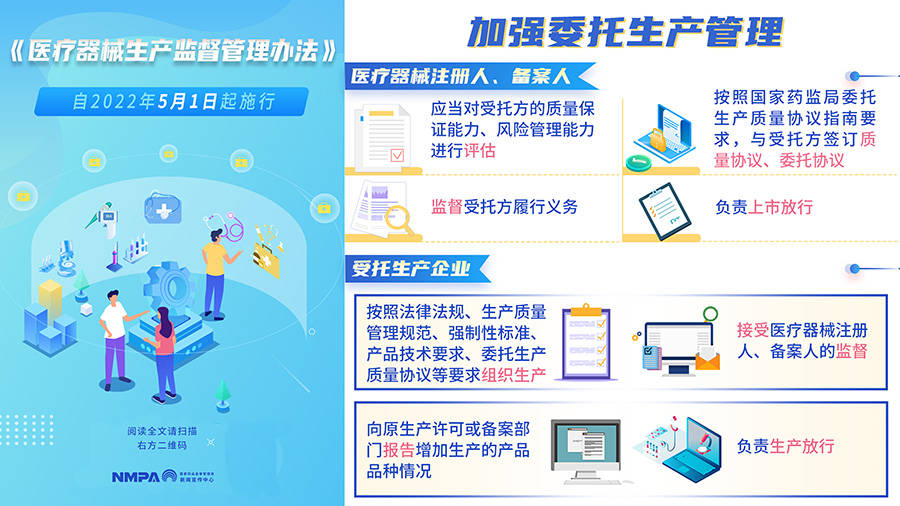
药监局三文中哪些体现发展医疗器械注册人制度? 1、《加强委托生产管理》
该文中,重点强调了注册人和受托生产企业的职责和权利,另外这里出现了备案人,我们都知道只有一类医疗器械的是属于注册备案制的,也就是说会放开一类的委托注册人,一类的也可以委托生产了。
医疗器械注册人,备案人应当对受托方的质量保证能力、风险管理能力进行评估,按照国家药监局委托生产质量协议指南要求,与受托方签订质量协议、委托协议,监督受托方履行义务,并负责上市放行。
受托生产企业按照法律法规、生产质量管理规范、强制性标准、产品技术要求、委托生产质量协议等要求组织生产,接受医疗器械注册人、备案人的监督,向原生产许可或备案部门报告增加生产的产品品种情况,负责生产放行
从这里可以看到,医疗器械的质量管理还是属于医疗器械注册人、备案人的责任,如果后续出现质量问题也是属于医疗器械注册人、备案人的问题,受托生产企业仅作为生产放行的作用。
2、《推行医疗器械注册人制度》
在《推行医疗器械注册人制度》的一文中,也同时明确了双方的责任划分,明确注册人和受托生产企业双方的责任和义务,规定注册人对医疗器械安全、有效负责;受托生产企业对本企业生产行为负责。于此同时,强化注册人甲钴胺,要求明确跨省委托生产监管要求,这里明确说明跨省委托将在全国放开,在哪里注册委托哪个地方的生产厂都是由注册人来决定。
