作者:米内网MENET
近日,FDA发布了2022新药年度报告,数据显示FDA去年共批准了37个创新药物上市,数量创近6年新低,其中近5成已在国内上市或在审评阶段。FDA通过“多管齐下”,用多种方式促进、加快新药审评。2022年多款国产创新药物“出海”闯关FDA,结果“喜忧参半”,2个国产创新药获FDA批准,4个碰壁。
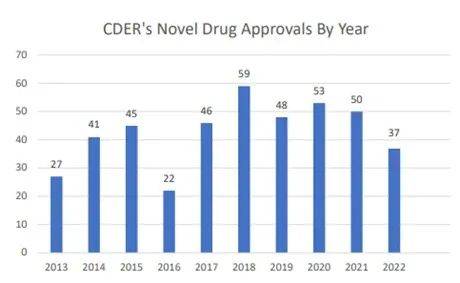
图1:近十年FDA获批新药数量
来源:FDA2022新药年度报告(New Drug Therapy Approvals 2022)
37个创新药获批,18个加速闯关中国市场
近日,美国FDA药物评价和研究中心(CDER)发布了2022新药年度报告。2022年FDA共批准了37个创新药物上市,数量创近6年新低。在获批的创新药物中,有20个(54%)属于“first-in-class”首创新药,20个(54%)是罕见病用药。
FDA作为全球医药监管的标杆,已获批准新药中,28个(76%)是首轮获批,25个(68%)先于其它国家在美国获批。
2022年FDA通过“多管齐下”,用多种方式促进和加快新药审评。12个(32%)被认定为快速通道,13个(35%)被认定为突破性治疗药物,21个(57%)被认定为优先审评,6个(16%)获得加速审批。CDER对2022年批准的所有新药中的24个(65%)使用了一项或多项加快开发和审评方法。
表1:2022年FDA获批的创新药情况
来源:FDA网站、米内网数据库
近几年,国内对创新药物的关注度越来越高。2022年在美国获批的创新药也在以“中国速度”加速奔跑进入中国市场,以解决更多中国患者未被满足的健康需求。据统计,目前已有18个(49%)创新药在国内处于申请临床及以上阶段。其中,阿布昔替尼、伏诺拉生、本维莫德、佩索利单抗4个创新药已获批上市,奥特康唑、氘可来昔替尼处于申请上市阶段,而处于临床III期的有9个创新药,临床I期的有1个,申请临床的有2个。
表2:创新药物在国内研发情况
来源:米内网数据库
2个国产创新药“出海”成功,传奇生物积极扩展版图
2022年多款国产创新药“出海”闯关FDA,西达基奥仑赛和本维莫德传回了可喜消息,成功获批上市。
2022年2月28日,金斯瑞旗下的传奇生物研发的BCMA CAR-T药品西达基奥仑赛获得FDA的批准上市,用于治疗复发或难治性多发性骨髓瘤。西达基奥仑赛成为中国首个获FDA批准的细胞治疗产品,及全球第2款获批靶向BCMA的CAR-T细胞免疫疗法。这在FDA宣布收紧中国创新药上市政策后,打了一个漂亮的“翻身仗”,更是意味着中国在细胞疗法这个领域,正式走到了世界一线的位置。
