本期看点
① 基石药业择捷美一线治疗食管鳞癌的注册性临床研究达到主要终点
② 燃石医学多癌种早检试剂盒OverC获FDA突破性医疗器械认定
③ 2023年度合生元营养与护理研究院母婴研究基金招标正式启动
④ 创胜集团TST003临床试验申请获国家药监局批准
⑤ 合成生物学企业依诺基科完成5000万元天使轮融资
⑥ 英赛斯宣布完成三轮近1.5亿元融资
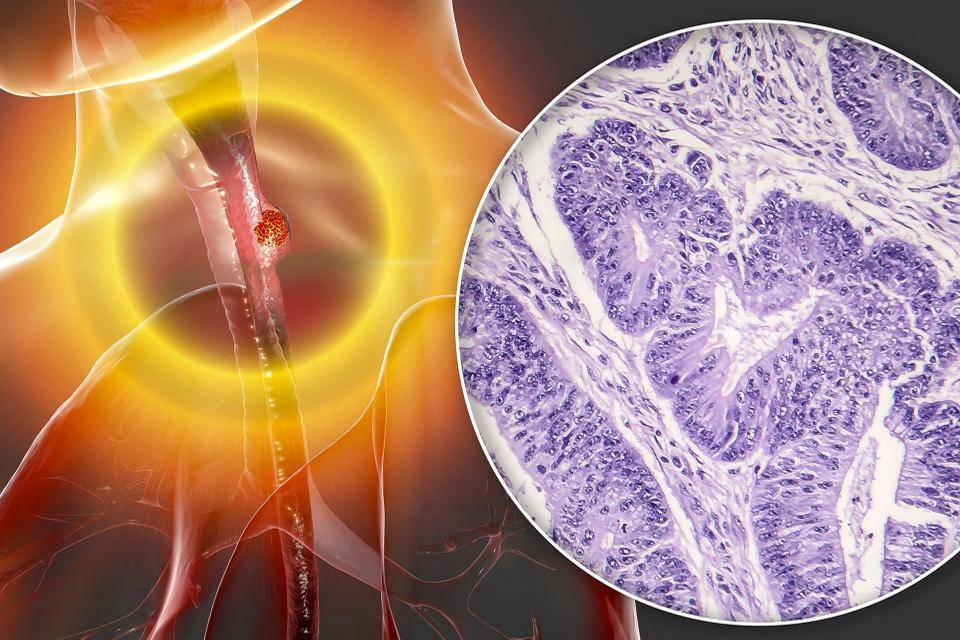
① 基石药业择捷美一线治疗食管鳞癌的注册性临床研究达到主要终点作者:基石药业
解读:Dayu
来源:基石药业官微
发布日期:2023-01-03
■ 内容要点1月3日,基石药业宣布,择捷美(舒格利单抗注射液)联合化疗一线治疗无法手术切除的局部晚期、复发或转移性食管鳞癌GEMSTONE-304研究达到主要研究终点。该研究结果标志着择捷美成为全球首个针对无法手术切除的局部晚期、复发或转移性食管鳞癌取得阳性结果的PD-L1单抗。
GEMSTONE-304研究是一项随机、双盲、多中心、安慰剂对照的3期注册性临床试验,旨在评估择捷美联合FP化疗方案(氟尿嘧啶+顺铂)作为一线治疗无法手术切除的局部晚期、复发或转移性食管鳞癌的疗效和安全性。
该试验的主要研究终点为盲态独立中心审阅委员会(BICR)评估的无进展生存期(PFS)和总生存期(OS),次要研究终点包括研究者评估的PFS、BICR和研究者评估的客观缓解率(ORR)及缓解持续时间(DoR)等。
研究结果显示,与安慰剂联合化疗相比,择捷美联合化疗明显改善BICR评估的PFS和OS,差异具有统计学显著性与临床意义。安全性与既往报道的择捷美相关临床研究结果一致,未发现新的安全性信号。
基于该结果,基石药业计划近期向中国国家药品监督管理局(NMPA)递交该项新适应症的上市申请。
原文链接:
https://mp.weixin.qq.com/s/x_NGCSgNT-YANh5LlNFCXw
② 燃石医学多癌种早检试剂盒OverC获FDA突破性医疗器械认定作者:Burning Rock
解读:Alex Zhang
来源:Biospace
发布日期:2023-01-03
■ 内容要点1月3日,燃石医学宣布其自主研发的多癌种早检产品OverC Multi-Cancer Detection Blood Test获得FDA授予的“突破性医疗器械”认定,成为全球第三个获得此项认定的多癌种早检产品。
2022年5月,OverC获得欧盟CE体外诊断试剂注册许可资质,为中美两地强大的技术平台和质量体系背书。
OverC可以通过抽取一管外周血(8~10毫升),为50-75岁的受检人筛查食道癌、肝癌、肺癌、卵巢癌和胰腺癌等多个癌种,并进行组织溯源,提示癌症相关甲基化信号的来源器官,临床医生可根据筛查结果进行针对性检查并进一步诊断。 在病例对照研究THUNDER中,OverC显示出了69.1%的敏感性和98.9%的特异性。
